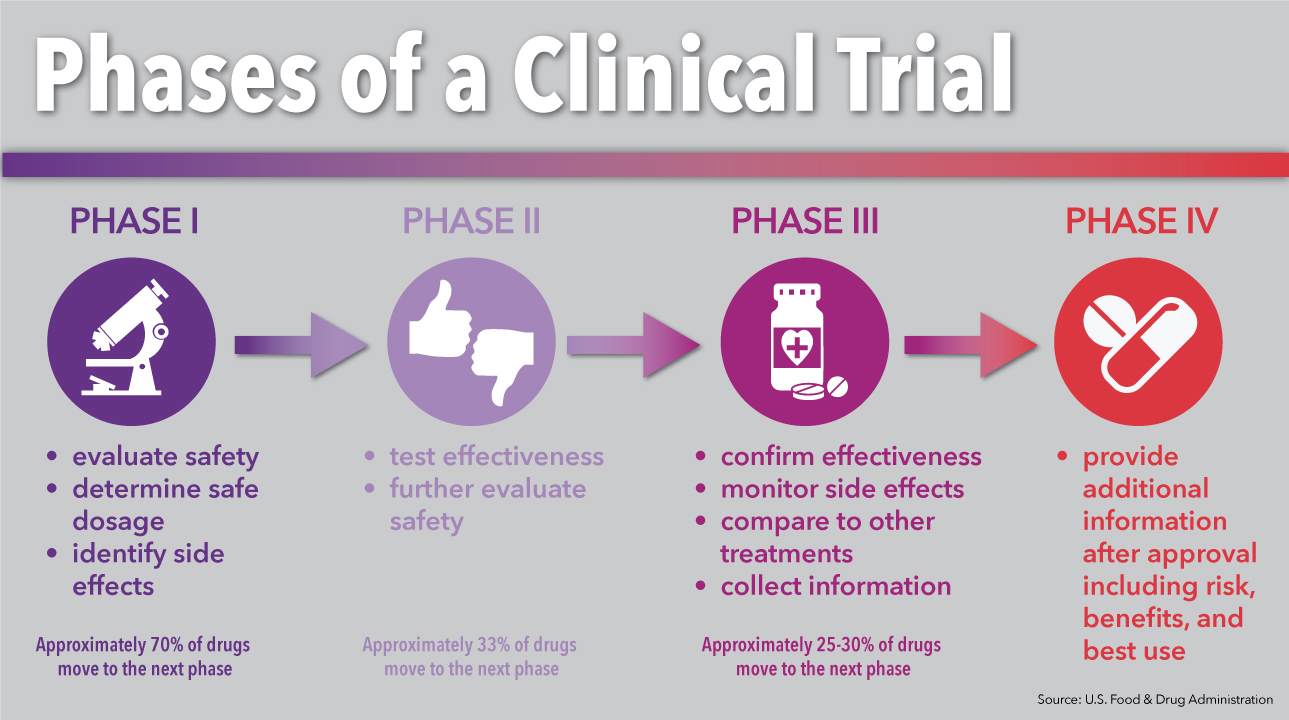
مطالعات بالینی یا کارآزمایی بالینی چیست؟
انواع مطالعات بالینی، شیوه نگارش و ثبت جهانی کارآزمایی بالینی

آیا در نظر دارید مطالعۀ بالینی انجام دهید؟ این نوشته در مورد نحوه اخذ تاییدیه، ثبت مطالعه و گزارش نتایج مطالعه به صورت بینالمللی مورد پذیرش FDA است.
شایان ذکر است مسئولیت این کار در ایران مرکز بینالمللی ثبت کارآزمایی های بالینی است که هماکنون به میزبانی دانشگاه علوم پزشکی ایران اداره میشود. وبسایت ارزشمند این مرکز در دسترس عموم است و راهنمای ثبت کارآزمایی به صورت کامل توضیح داده شده است.
مطالعات بالینی معمولا بر روی داوطلبین انسانی انجام میگیرند (که به آنها شرکت کننده نیز گفته میشود). هدف از انجام مطالعات بالینی افزایش دانش پزشکی و یافتن راههای بهتری برای پیشگیری، غربالگری، تشخیص و یا درمان بیماری است. هر مطالعه بالینی باید دارای پروتکلی باشد که آنچه را که در مطالعه انجام خواهد شد، نحوه انجام مطالعه و علت نیاز به بخشهای جداگانه مطالعه را توضیح دهد. مطالعه ممکن است متشکل از داوطلبینی باشد که دارای بیماری خاصی بوده و یا سالم هستند.
هدف از انجام اکثر مطالعات بالینی تعیین اثربخشی و ایمنی یک آزمایش یا درمان جدید است. مطالعات بالینی ممکن است به سایر جنبههای دیگر مراقبت، از جمله بهبود کیفیت زندگی افرادی که دارای بیماریهای مزمن هستند، نیز بپردازند.
پیشتر در موضوعات پزشکی منتشر کردهایم:
انواع مطالعات بالینی
مطالعات بالینی مداخلهای و مشاهدهای
در مطالعات مداخلهای، شرکت کنندگان مداخلات خاصی را بر اساس پروتکلی که توسط محققین به وجود آمده است دریافت میکنند. این مداخلات ممکن است تغییر در رفتار شرکت کنندگان، روشهای جراحی یا محصولات پزشکی مانند داروها یا وسایل باشند.
هدف این است که ایمنی و اثربخشی مداخله از طریق اندازهگیری پیامدهای مشخص در شرکت کنندگان تعیین شود. برای مثال، محققین ممکن است دارو یا درمانی را به شرکت کنندگانی که فشار خون بالا دارند بدهند تا ببینند که آیا فشار خون آنها کاهش مییابد یا نه.
در مطالعات مشاهدهای، شرکت کنندگان ممکن است به عنوان بخشی از مراقبت پزشکی معمول خود مداخله یا روشی را دریافت کنند، اما (برخلاف مطالعات مداخلهای) مداخلۀ خاصی برای شرکت کنندگان توسط محققین در نظر گرفته نمیشود. برای مثال، محققین ممکن است گروهی از بزرگسالان مسن را تحت نظر قرار دهند تا در مورد اثر سبکهای زندگی مختلف بر سلامت قلب اطلاعات بیشتری به دست آورند.
مطالعات بالینی آیندهنگر و گذشتهنگر
در مطالعات آیندهنگر، محققین در طول مطالعه به پیامدها توجه میکنند، مانند ایجاد بیماری، و آن را به عوامل دیگری، مانند عوامل پیشگیری و خطر مشکوک، ربط میدهند. این نوع مطالعه معمولا متشکل از گروهی از آزمودنیها در یک دوره زمانی طولانی است. پیامد مورد نظر باید در جمعیت تحت مطالعه مشترک باشد؛ در غیر این صورت، تعداد پیامدهای مشاهده شده کم بوده و از لحاظ آماری بیمعنی خواهد بود.
باید تمام تلاش را به کار گرفت تا از سوگیریهایی مانند عدم پیگیری تمایزی ممانعت کرد. مطالعات آیندهنگر معمولا منابع بالقوه سوگیری و مخدوشگر کمتری نسبت به مطالعات گذشتهنگر دارند.
در مطالعات گذشتهنگر، محققین دادههای موجود را بررسی کرده و مواجهه با عوامل پیشگیری یا خطر مشکوک را در رابطه با پیامدی که در آغاز مطالعه وجود داشته است میآزمایند. بسیاری از مطالعات ارزشمند مورد-شاهد، همانند مطالعۀ لین و کلیپتون (1926) در مورد عوامل خطر سرطان پستان، از نوع گذشتهنگر هستند.
خدشه و سوگیری در مطالعات گذشتهنگر بیشتر از مطالعات آیندهنگر اتفاق میافتند. به همین دلیل است که تحقیقات گذشتهنگر مورد انتقاد قرار میگیرند. در صورتی که پیامد مورد نظر شایع نباشد، در تحقیقات آیندهنگر حجم نمونه برای تخمین خطر نسبی اغلب بسیار بزرگ بوده و در نتیجه این نوع تحقیق قابل انجام نیست، به همین دلیل باید مطالعات گذشتهنگر انجام داد. در مطالعات گذشتهنگر، نسبت شانس تخمینی از خطر نسبی را ارائه میدهد.
مطالعات بالینی مورد شاهد و همگروهی (کوهورت)
مطالعات مورد شاهد به مطالعاتی گفته میشود که بیماران مبتلا به یک بیماری یا دارای پیامد مورد نظر (موردها) را با بیمارانی که فاقد بیماری یا پیامد هستند (شاهدها) مقایسه میکنند. در این مطالعات، محققین با نگاه گذشتهنگر، فراوانی مواجهه با عامل خطری را که در هر گروه وجود دارد مقایسه میکنند تا رابطه میان عامل خطر و بیماری را تعیین کنند.
این مقاله توسط تیم تخصصی ترجمه پزشکی شبکه مترجمین ایران ترجمه شده است.
این موسسه آمادگی دارد تا کلیه متون تخصصی شما در زمینه پزشکی از انگلیسی به فارسی و بالعکس ترجمه کند.
کافیست فایل خود را در لینک زیر ارسال کنید تا سایر مراحل در اسرع وقت انجام شود:
ارسال پروژه ترجمهشاهدها بر اساس یک پیامد ناشناخته انتخاب میشوند. مطالعات مورد-شاهد معمولا برای بررسی پیامدهای نادر خوب هستند. این مطالعات در مقایسه با مطالعات همگروهی نسبتا ارزانتر هستند، زیرا به تعداد شرکت کنندگان کمتری نیاز داشته و سریعتر به پایان میرسند. با این حال، مطالعات مورد-شاهد مستعد سوگیری انتخاب و سوگیری یادآوری/گذشتهنگر هستند.
مطالعات همگروهی به مطالعاتی گفته میشود که در آن یک یا چند نمونه (با عنوان همگروهیها) به صورت آیندهنگر پیگیری شده و وضعیت آنها با توجه به بیماری یا پیامد ارزیابی میشود تا مشخص شود که کدام یک از ویژگیهای مواجهه اولیه (عوامل خطر) با بیماری یا پیامد ارتباط دارند. در طول انجام مطالعه، پیامد شرکت کنندگان در هر گروه ارزیابی شده و ارتباط آن با ویژگیهای خاص تعیین میشود.
این مطالعات معمولا (اما نه همیشه) آیندهنگر هستند و منجر به تعیین نرخهای بروز واقعی و خطرات نسبی شده و ممکن است ارتباطات پیشبینی نشدهای را با پیامد آشکار کنند. این مطالعات برای بررسی پیامدهای شایع عالی بوده ولی در مقایسه با مطالعات مورد-شاهد نسبتا گران هستند، زیرا به تعداد شرکت کنندگان نسبتا زیادی نیاز داشته و در زمان طولانیتری به پایان میرسند. مطالعات همگروهی ممکن است مستعد سوگیری ریزش و سوگیری همراه با تغییر روشها در طول زمان همراه باشند.
نحوه اخذ تاییده و ثبت کارآزمایی بالینی
اکثر مطالعات بالینی توسط هیئت بررسی نهادی (IRB) بررسی، پایش و تایید میشوند. این هیئت متشکل از پزشکان، متخصصین آمار و اعضای جامعه هستند. نقش آنها این است که از رعایت اخلاق در مطالعه اطمینان حاصل کنند، از حقوق و رفاه شرکت کنندگان محافظت کنند و مطمئن شوند که میزان خطرات در مقایسه با منافع احتمالی منطقی است.
در ایالات متحده، کارآزماییهای بالینی بر روی داروها، محصولات زیستی یا وسایل پزشکی که تحت نظارت سازمان غذا و دارو (FDA) هستند و یا کارآزماییهایی که با سرمایه و یا توسط دولت فدرال انجام میگیرند باید تاییدیه IRB داشته باشند.
بر اساس الزام کمیتۀ بینالمللی سردبیران مجلات پزشکی (ICMJE)، کارآزماییهای بالینی از اول ماه ژوئیه سال 2005 باید پیش از انتشار نتایج خود ثبت شوند. وبسایت ClinicalTrials.gov که توسط کتابخانۀ ملی پزشکی (NLM) ایالات متحده اداره میشود اولین سایت و در حال حاضر بزرگترین و پرکاربردترین سایت ثبت آنلاین کارآزماییهای بالینی است.
ثبت کارآزماییهای بالینی حائز اهمیت است زیرا شفافیت و دسترسی به نتایج و پروتکلهای کارآزماییهای بالینی را افزایش میدهد. هرچند وبسایت ClinicalTrials.gov امکان ثبت کارآزماییها را در هر زمان از مطالعه (پس از شروع، پس از تکمیل انتخاب شرکت کنندگان، یا حتی پس از تکمیل مطالعه) به وجود میآورد، بر اساس الزامات سختگیرانۀ ICMJE، مطالعات باید پیش یا در زمان انتخاب اولین بیمار ثبت شوند (ثبت آیندهنگر). در صورتی که یک کارآزمایی بالینی به صورت آیندهنگر ثبت نشود، ممکن است نتوان آن را در مجلاتی که از دستورالعملهای ICMJE پیروی میکنند منتشر کرد.
فرم جستجوی ساده در این سایت را در شکل زیر ملاحظه میکنید.
با آغاز برنامه ثبت کارآزماییهای بالینی بینالمللی، سازمان بهداشت جهانی فشار برای ثبت کارآزماییهای بالینی را شروع کرده است. صنعت داروسازی نیز فعالیتهایی را انجام داده و طرحهایی را برای شفافیت و دسترسی عمومی هرچه بیشتر دادههای کارآزماییهای بالینی ارائه کرده است. بیانیه هلسینکی که در اکتبر سال 2008 منتشر شد بیان میکند که «همۀ کارآزماییهای بالینی باید پیش از انتخاب اولین آزمودنی خود در پایگاه دادههایی که در دسترس همگان است ثبت شوند.»
گزارش نتایج کارآزمایی بالینی
مقاله شما پس از انتشار توسط جامعه علمی خوانده و نقد خواهد شد. دادههایی که منتشر میکنید ممکن است مطالعات مروری نظاممند، دستورالعملهای بالینی و یا شیوههای بالینی را تحت تاثیر قرار دهند.
نتایج مطالعه خود را بر اساس دستورالعملهای مناسب گزارش کنید. شبکه EQUATOR یک درخت تصمیمگیری نمونه طراحی کرده است که به شما امکان میدهد تا دستورالعمل صحیح برای گزارش کار خود را انتخاب کنید.
شبکه EQUATOR طی همکاری با پژوهش پنهلوپه یک برنامه آنلاین را طراحی کرده است که میتواند به فرآیند انتخاب کمک کند. توجه کنید که این برنامه فقط شامل دستورالعملهای گزارشدهی متداول برای مطالعات عمومی بوده و بسیاری از دستورالعملهای مورد نیاز برای کارآزماییهایی که با روشهای غیراستاندارد انجام شدهاند را در برنمیگیرد.
جدول 1: دستورالعملهای گزارشدهی برای انواع مطالعات اصلی
(همۀ لینکها در این جدول از سایت http://www.equator-network.org/ گرفته شدهاند).
| نوع مطالعه | دستورالعمل گزارشدهی |
| کارآزمایی تصادفی | CONSORT |
| مطالعه مشاهدهای | STROBE |
| مطالعه مروری نظاممند | PRISMA |
| گزارش مورد | CARE |
| تحقیق کیفی | SRQR, COREQ |
| مطالعه تشخیصی/پیشآگهی | STARD, TRIPOD |
| مطالعه بهبود کیفیت | SQUIRE |
| ارزیابی اقتصادی | CHEERS |
| مطالعه پیشبالینی جانوری | ARRIVE |
| پروتکل مطالعه | SPIRIT, PRISMA-P |
| دستورالعملهای شیوه بالینی | AGREE, RIGHT |